王科强-化学方程式的配平问题
化学方程式的配平问题
苏州市苏州高新区第一中学 王科强
根据课程标准和高考评价,表达是各科教学的重要内容之一。而用化学方程式表示物质的转化与变化,正是是化学学习与研究的必备基本知识与基本技能。作为高考重要考点——化学方程式的配平需注重这几个方面:
1.一般思路
质量守恒定律,可细分为三个方面的守恒:电子守恒→电荷守恒→原子守恒。
例一 (2022·连云港期中)在弱酸性条件下,fe2+与no反应得到fe(oh)3和n2,反应的离子方程式为
第一步:电子守恒(氧还反应配平)fe失电子、n得电子
10fe2++2no===10fe(oh)3↓+n2↑
第二步:电荷守恒(离子反应配平)反应前后电荷保持一致
10fe2++2no===10fe(oh)3↓+n2↑+18h+(酸性条件)
第三步:原子守恒(化学方程式)质量守恒定律
10fe2++2no+24h2o===10fe(oh)3↓+n2↑+18h+ 。
练① (2023·泰州期末)“除铁”时,先加入h2o2,后加入mnco3固体。加入mnco3固体时有co2生成,反应的离子方程式为:
3mnco3+2fe3++3h2o===3mn2++2fe(oh)3+3co2↑ 。
练②(2022·苏州期中)取一定质量的bacro4和对应量的水加入三颈烧瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成crcl3并放出co2气体。上述反应的化学方程式为
c2h5oh+4bacro4+20hcl(浓)2co2↑+4crcl3+13h2o+4bacl2
2.定组成技巧
作为配平的辅助手段,一些物质的化学式的固定组成,使得原子间个数关系保持固定比例。
例二 (2023·常州期末)bi2s3和mno2在空气中焙烧生成bi2o3和mnso4。该反应的化学方程式为
化学式mnso4中n(mn):n(s)=1:1使得n(bi2s3):n(mno2)=1:3
2bi2s3+6mno2+9o22bi2o3+6mnso4 。
练③(2023·扬州中学)lifepo4电极材料是动力型锂离子电池的理想正极材料。它可以通过h3po4、lioh和(nh4)2fe(so4)2溶液发生共沉淀反应。写出反应的化学方程式:
提示:化学式(nh4)2fe(so4)2中n(n):n(s)=1:1
(nh4)2fe(so4)2 +lioh+h3po4===lifepo4↓+2nh4hso4+h2o
3.平均价态技巧
根据化合物中元素正负化合价的代数和为零,可根据熟悉的化合价推测未知的化合价,即使是错误的也不影响配平,只关心化合价变化,甚至是虚构变化,这仅仅是处理技巧。
例三 (2023·连云港2月调研)硫脲[cs(nh2)2]与酸性kmno4溶液反应转化为两种无毒的气体及so,同时生成mn2+,该反应的离子方程式为
cs(nh2)2中h 1、n-3、s-2、c 4,
mn: 7→ 2,降5;
s:-2→ 6升,升8;n:-3→0,升3;且n(s):n(n)=1:2,共同升高14
14mno+5cs(nh2)2+32h+===14mn2++5co2↑+5n2↑+5so+26h2o 。
练④ (2023·南通二模)工业废水ph=9时,k2feo4氧化c2h5sh生成c2h5so和fe(oh)3,反应的离子方程式为 2feo+c2h5sh +4h2o===c2h5so+3oh-+2fe(oh)3↓ 。
练⑤ (2022·海安期中)写出·oh氧化甘氨酸根(c2nh4o)生成no、co2的离子方程式:
提示·oh中氧为-1
14·oh+c2nh4o===no+2co2↑+9h2o
练⑥ (2022·南京六校联考)(nh4)2s2o8可用于检验废水中的cr3+是否超标,如果超标,溶液会变成橙色(cr2o),写出该反应的离子方程式:
提示:s2o中s可按 7处理,若知道结构期中两个氧为-1
2cr3++3s2o+7h2o===6so+cr2o+14h+
4.组合技巧
利用反应机理以及盖斯定律,通过已知反应的加加减减求未知反应的化学方程式。
例四(2022·南京一中)一种通过bao和ba(no3)2的相互转化脱除no2的原理如图所示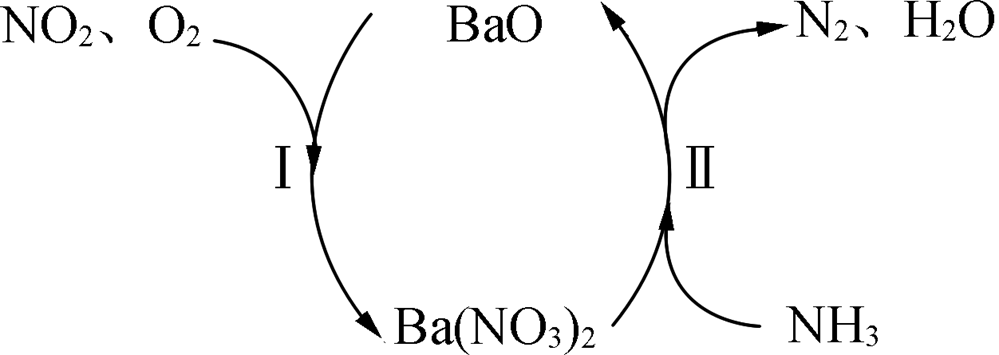 ,脱除no2的总反应为
,脱除no2的总反应为
反应ⅰ:4no2+2bao+o2=2ba(no3)2
反应ⅱ:3ba(no3)2+10nh3=8n2+3bao+15h2o
ⅰ×3+ⅱ×2,得总反应:12no2+20nh3+3o216n2+30h2o

用户登录